Une nouvelle étude de l’Université de Californie San Diego révèle que PHGDH, un gène identifié jusque-là comme simple biomarqueur de la maladie d’Alzheimer, joue en réalité un rôle causatif. Grâce à l’intelligence artificielle, les chercheurs ont mis au jour une « seconde fonction » de PHGDH et proposé un traitement potentiel pour bloquer cette activité néfaste.
Mais comment l’IA parvient-elle à percer les mystères d’un trouble aussi complexe ? Plongeons dans les détails fascinants de cette recherche.
Contexte et enjeux d’Alzheimer
Une maladie aux causes encore mystérieuses
Alzheimer touche près d’une personne sur neuf après 65 ans et reste la principale cause de démence. Si certaines formes familiales sont liées à des mutations génétiques rares, la majorité des cas dits « spontanés » ne s’expliquent pas par les gènes connus. Comprendre ces facteurs « cachés » est essentiel pour développer des traitements plus efficaces et précoces.
Les limites des traitements actuels
Aujourd’hui, les options thérapeutiques sont limitées et souvent peu efficaces, car elles interviennent trop tard dans la cascade moléculaire d’Alzheimer. Les approches anti-plaques amyloïdes n’apportent qu’un bénéfice modeste, soulignant l’urgence de cibler des mécanismes en amont de la formation de ces agrégats.
PHGDH, du biomarqueur à la piste causale
La connexion entre PHGDH et la progression de la maladie
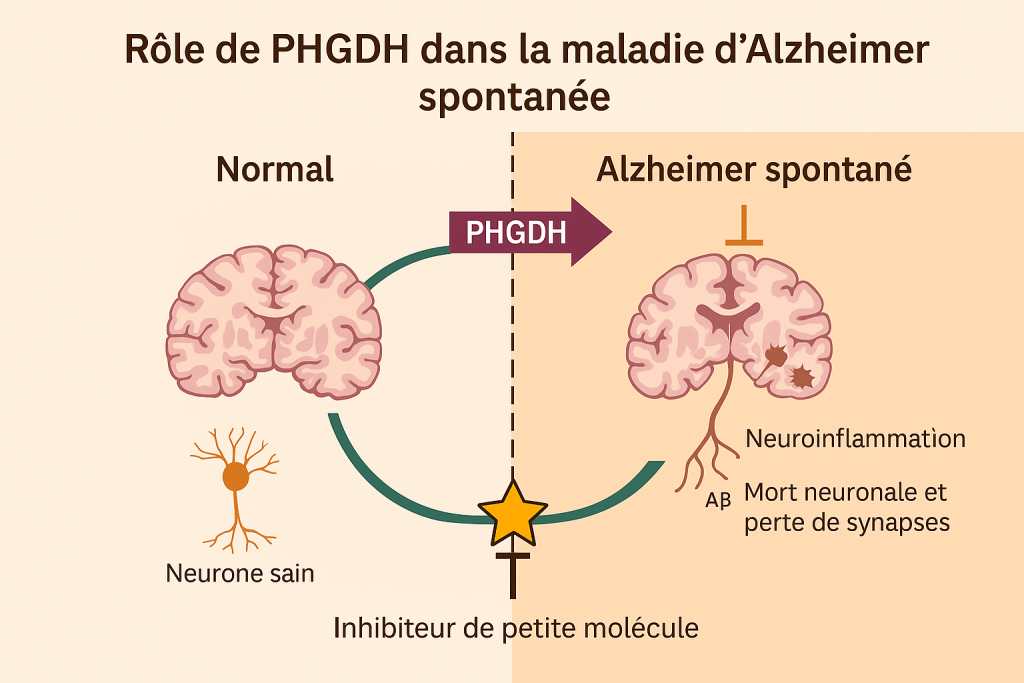
Jusqu’à présent, le gène PHGDH (phosphoglycérate déshydrogénase) était connu pour son rôle dans la production de sérine, un acide aminé essentiel pour le cerveau. Décrit comme un marqueur précoce de la maladie d’Alzheimer, sa suractivité était corrélée à la sévérité des lésions cérébrales, mais sans preuve de causalité. L’équipe de Sheng Zhong (UC San Diego) a désormais démontré que PHGDH n’est pas seulement un indicateur passif. Elle avait d’abord repéré PHGDH dans le sang comme un possible marqueur précoce d’Alzheimer. Des études ultérieures ont confirmé que plus l’expression de PHGDH – tant en ARN qu’en protéine – est élevée, plus la maladie est avancée, et ce dans plusieurs cohortes indépendantes.
De la corrélation à la causalité
Pour tester un lien de cause à effet, les chercheurs ont manipulé l’expression de PHGDH chez la souris et dans des organoïdes cérébraux humains. Baisser son niveau a ralenti la progression de la pathologie, tandis que l’augmenter l’a accélérée, démontrant que PHGDH n’est pas qu’un témoin, mais bien un acteur direct de l’Alzheimer « spontané ».
Le mystère du « Moonlighting » résolu par l’intelligence artificielle
Une fonction régulatrice inédite
Le tournant est survenu lorsque les chercheurs ont découvert un rôle caché de la protéine PHGDH . Grâce à l’IA, ils ont identifié une sous-structure similaire à des domaines de liaison à l’ADN présents dans des facteurs de transcription. Ce « moonlighting » (fonction secondaire) permet à PHGDH d’activer deux gènes clés, perturbant l’équilibre épigénétique du cerveau et déclenchant une cascade pathologique.
Exploration structurale en 3D
Grâce à l’intelligence artificielle, l’équipe a modélisé la structure tridimensionnelle de PHGDH et découvert qu’il possède un domaine se liant à l’ADN, très similaire à celui des facteurs de transcription. Cette capacité inédite lui permet d’activer deux gènes critiques, déséquilibrant la régulation génétique cérébrale et amorçant la neurodégénérescence.
Une thérapie potentielle : Cibler le rôle régulateur de PHGDH
NCT-503 : Un inhibiteur ciblant la fonction secondaire
Les chercheurs ont testé une molécule, le NCT-503 , capable de traverser la barrière hémato-encéphalique. Contrairement aux traitements existants, cette molécule ne bloque pas la production de sérine (essentielle au cerveau), mais inhibe spécifiquement le rôle régulateur toxique de PHGDH .
Des résultats prometteurs chez les modèles murins
Sur deux modèles de souris, NCT-503 a réduit la formation de plaques amyloïdes, amélioré la mémoire et diminué l’anxiété. Ces effets soulignent l’efficacité potentielle d’une approche ciblant les causes précoces de la maladie.
Les limites et perspectives
Modèles animaux et étapes cliniques
Aucun modèle de souris ne reproduit parfaitement l’Alzheimer spontané, et NCT-503 reste à valider dans des essais cliniques. Les prochaines étapes incluent l’optimisation du composé, des études de toxicologie pré-industrielle et un dépôt de dossier IND auprès de la FDA.
Vers de nouveaux traitements oraux
L’équipe prévoit d’optimiser NCT-503 et de le soumettre à des études précliniques pour validation par la FDA
L’avantage des petites molécules, comme NCT-503, est leur administration potentiellement orale, plus simple et moins invasive que les perfusions actuelles. Cette découverte ouvre la voie à toute une nouvelle classe de médicaments ciblant non seulement PHGDH, mais peut-être d’autres protéines « moonlighting » impliquées dans les maladies neurodégénératives.